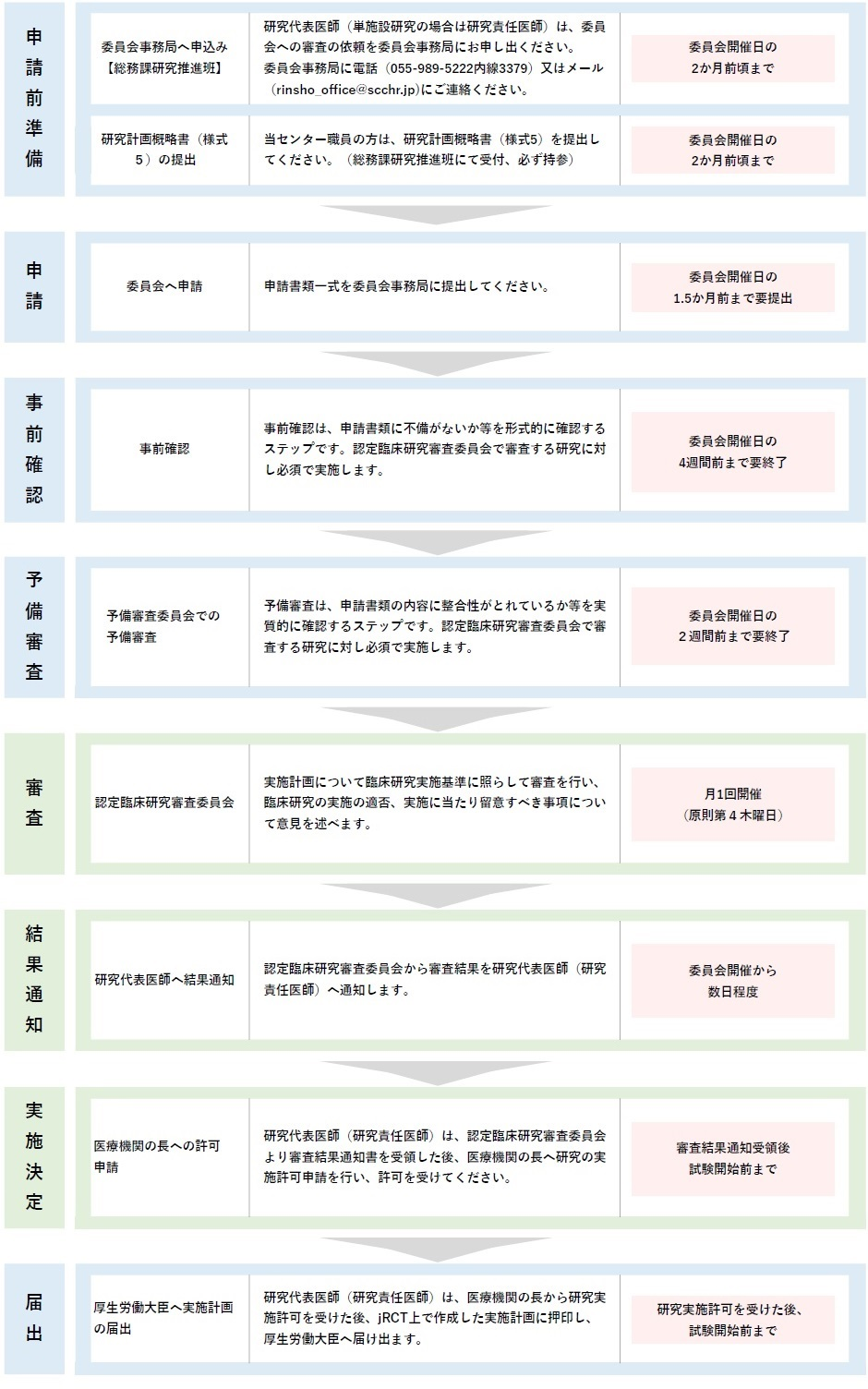
特定臨床研究 申請の流れ
認定臨床研究審査委員会へ臨床研究の審査を申請する場合の流れは、次のとおりです。
研究責任医師(多施設共同研究の場合は研究代表医師)は、申請に必要な書類を揃え、委員会事務局へお申込みください。認定臨床研究審査委員会は月に1回(原則として第4木曜日)開催されます。申請書類の提出から委員会での審議までにおよそ2か月かかりますので、ご了承ください。
審査の流れ(例:新規申請)
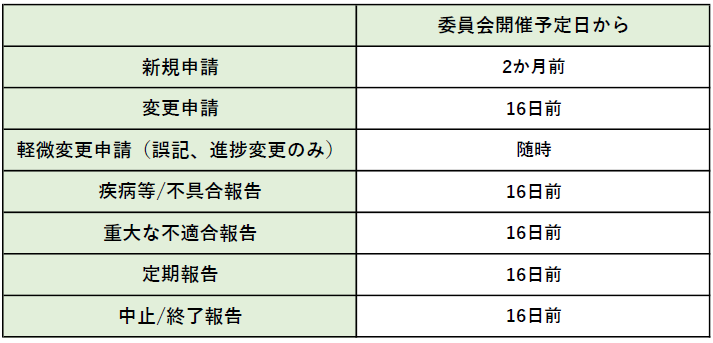
書類受付期限
・書類受付期限に提出された場合でも、書類の不備不足等により予定の委員会開催日に審議出来ない場合があります。
・申請締め切り日が土日休日に重なる場合は、その前の平日が締め切り日になります。
・長期休暇(GW・年末年始等)が間に入る場合は、締め切り日を前倒しする場合があります。
令和7年度委員会審査受付状況(随時更新)
| 回次/CRB開催日 | 委員会審査申請期限 | 簡便な審査申請期限 |
|---|---|---|
| 第 1回 2025年 4月24日【木】 | ***終了*** | 〈随時〉 |
| 第 2回 2025年 5月22日【木】 | ***終了*** | 〈随時〉 |
| 第 3回 2025年 6月26日【木】 | ***終了*** | 〈随時〉 |
| 第 4回 2025年 7月24日【木】 | ***終了*** | 〈随時〉 |
| 第 5回 2025年 8月28日【木】 | ***終了*** | 〈随時〉 |
| 第 6回 2025年 9月25日【木】 | ***終了*** | 〈随時〉 |
| 第 7回 2025年10月23日【木】 | ***終了*** | 〈随時〉 |
| 第 8回 2025年11月27日【木】 | ***終了*** | 〈随時〉 |
| 第 9回 2025年12月25日【木】 | ***終了*** | 〈随時〉 |
| 第10回 2026年 1月22日【木】 | ***終了*** | 〈随時〉 |
| 第11回 2026年 2月26日【木】 | ***終了*** | 〈随時〉 |
| 第12回 2026年 3月26日【木】 | 2026年 3月10日【火】 | 〈随時〉 |
※1. 委員会審査申請期限は、安全性情報・重篤な副作用情報・逸脱報告・変更・新規申請書類となります。
※2. 新規試験につきましては、申請期限までに事前・予備審査を終了している必要があります。
認定臨床研究審査委員会への提出書類
認定臨床研究審査委員会関係様式については、厚生労働省ホームページ(http://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000163417.html)にて示されている様式等を用いて提出してください。
1.新規審査依頼書
様式に必要事項を記入したうえでご提出ください。
2.実施計画
実施計画とは、臨床研究法で定められた様式で、研究計画書(プロトコール)や研究責任医師(多施設共同研究の場合は研究代表医師)が作成し、認定臨床研究審査委員会の審査を経て厚生労働大臣に提出することが義務付けられています。
臨床研究の実施中に実施計画を変更する場合は、変更する度に必ず認定臨床研究審査委員会で審査を行い、厚生労働大臣へ提出することが必要となります。
※厚生労働大臣への実施計画提出時は、jRCT(厚生労働省の整備するデータベース)にアクセスし、必要事項を入力してご作成ください。
3.利益相反管理に関する文書
利益相反(COI)申告者は、企業等が製造または販売する、もしくは製造または販売しようとする医薬品・医療機器等を用いる研究を行う場合には、研究者が所属する機関に【様式C】を提出し、助言・指導を受け確認結果を受領することが定められています。
当センターでは、利益相反審査委員会にて【様式C】の確認業務を行っております。当センター以外の研究責任(代表)医師の方は、所属する医療機関にて【様式C】の確認を行っていただき、【様式D】を入手したうえで、当センター認定臨床研究審査委員会へ【様式A】及び【様式E】を提出してください。
4.研究計画書(プロトコール)
研究計画書に、臨床研究法で求められる下記の項目がすべて記載されているかどうかを確認し、完成したものをご提出ください。
研究計画書に記載すべき事項
- 臨床研究の実施体制
- 臨床研究の背景
- 臨床研究の目的
- 臨床研究の内容
- 対象者の選択・除外、研究の中止に関する基準
- 対象者に対する治療
- 有効性の評価
- 安全性の評価
- 統計的な解析
- 原資料等の閲覧に関する事項
- 品質管理及び品質保証
- 倫理的な配慮
- 記録(データを含む)の取り扱い及び保存に関する事項
- 金銭の支払い及び補償に関する事項
- 情報の公表に関する事項
- 実施期間
- 対象者に対する説明・同意(様式の作成を含む)
- その他、臨床研究の適正な実施のために必要な事項
5.同意説明文書
被験者への同意説明の内容を実施計画に記載する必要がありますので、実施計画の前に同意説明文書を作成しておくことをお勧めいたします。
6.分担医師リスト
当該臨床研究を実施する研究責任医師、分担医師の氏名を記載したリストをご提出ください。 多施設共同研究の場合は施設ごとに研究責任医師が分担医師リストを作成し、研究代表医師が取りまとめて提出してください。
7.症例報告書の見本
症例報告書を作成した場合には、ご提出ください。
8.医薬品等概要書
承認されている医薬品等を用いる研究の場合は、添付文書等をご提出ください。
9.疾病等が発生した場合の対応に関する手順書
10.モニタリングに関する手順書
モニタリング(中央モニタリングを含む)の手順書をご提出ください。
11.監査に関する手順書
監査を実施する場合は、手順書をご提出ください。
12.統計解析計画書
統計解析計画書を作成した場合は、ご提出ください。
13.被験者の健康被害の補償について説明した文書
被験者への支払いがある場合は、それに関する資料を含みます。
14.被験者の募集の手順に関する資料
被験者の募集に際し広告等を用いる場合は、その手順を記載した資料をご提出ください。