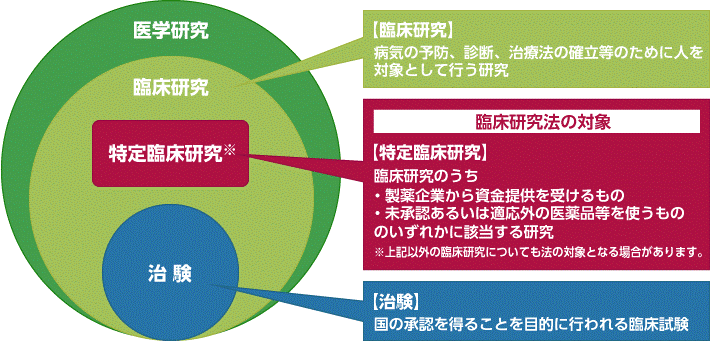
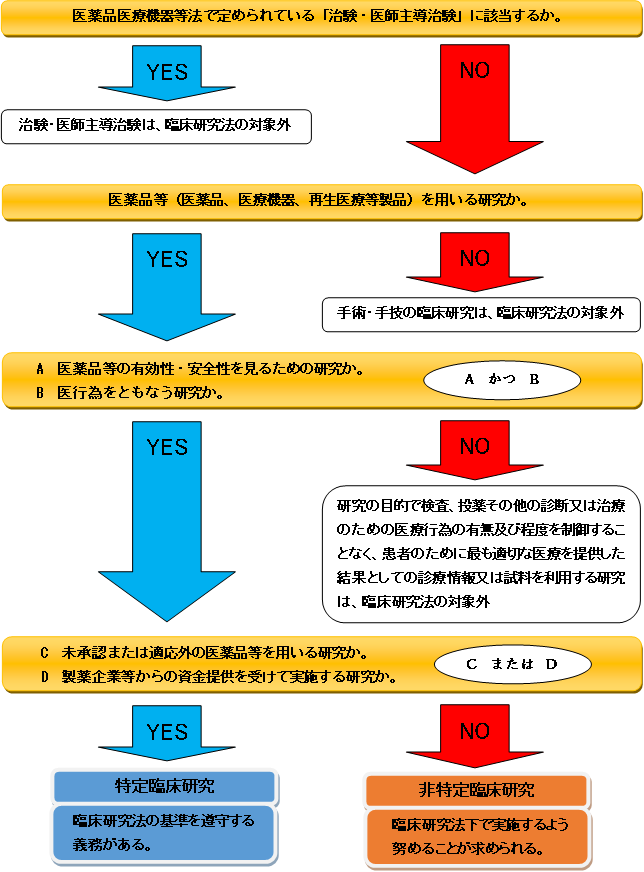
特定臨床研究とは
臨床研究法において、臨床研究とは“医薬品等を人に対して用いることにより、当該医薬品等の有効性又は安全性を明らかにする研究”と定められています。特定臨床研究とは、臨床研究のうち以下の2つのいずれかに該当する研究を指します。
製薬企業から資金の提供を受けて行われる臨床研究
臨床研究では、研究の実施に必要となる資金を、製薬企業から提供を受けて実施する場合があります。この場合には、病院と製薬企業が契約を結び、提供を受ける研究費の金額や使用目的を明確にしたうえで、透明性を確保して行われます。
「未承認」又は「適応外」の医薬品等を用いて行われる臨床研究
新しい薬・機器・再生医療等製品は、国の承認を受けることで適応疾患に対して使うことができるようになります。まだ日本で承認されていない薬を「未承認薬」といいます。また、ある疾患に対しては承認されているものの別の疾患への効能は承認されていない薬を「適応外薬」といいます。「未承認」または「適応外」の医薬品等を用いて、新しい治療法を確立するための臨床研究が行われます。
※医薬品等・・・医薬品、医療機器、再生医療等製品が含まれます。
※純粋な観察研究を除く医薬品等の臨床研究は、臨床研究法の対象となる場合があります。
なお、国の承認を得ることを目的として行われる「治験」、上記に該当しても過去の診療データを使って行われる研究と、前向きに通常診療のデータを用いて行われるような研究は「観察研究」と呼ばれ、治験と観察研究は特定臨床研究には該当しません。
臨床研究法では、研究に参加していただく患者さんに対して説明し、同意を得ることが医師に義務付けられています。実際に研究への参加を打診された場合は、担当医の話を聞き、患者さんご自身の意思で参加するかどうかを決めることが大切です。