国内初 全ゲノム解析・RNAシーケンシングを併用するゲノム検査に対応した「がんゲノム医療統合システム」を構築
国内初 全ゲノム解析・RNAシーケンシングを併用するゲノム検査に対応した「がんゲノム医療統合システム」を構築
~がんゲノム検査結果報告書の作成、従事者の業務負担の軽減に寄与~
がんゲノム医療のDXに貢献
2024年3月25日
静岡県立静岡がんセンター
静岡がんセンター(以下、当施設)は、国内初の全ゲノム解析※1およびRNAシーケンシング(以下、RNA-seq※2)を併用するゲノム検査に対応した「がんゲノム医療統合システム (がんゲノム検査業務支援・報告書作成システム)」を構築し、4月からのテスト運用の後、7月より運用を開始します。
本システムは、全ゲノム解析を臨床検査として実施する上で求められる情報量と質が確保された検査結果報告書の作成が可能であり、システム内データベースに蓄積されるゲノムビッグデータを活用する機能を有するとともに、「がんゲノム医療」の課題に挙げられている従事者の業務負担軽減に寄与します。また、新たなゲノム検査製品等にも対応可能なシステムです。
なお、本システムは、2021年より当施設が参画している全ゲノム解析の臨床実装を目的とした国家プロジェクトにおいて、国立研究開発法人日本医療研究開発機構(以下、AMED)の支援のもと構築されました※3。
背景
「がんゲノム医療」は、患者一人ひとりの腫瘍のゲノム情報を調べるゲノム検査の結果に基づき、がんと関連のある遺伝子変化に対応する最適な治療や薬剤を提供する新たな医療です。
当施設では、2014年に開始したがんゲノム臨床研究「プロジェクトHOPE (High-tech Omics-based Patient Evaluation) ※4」により、この10年間で約12,000症例からなる日本人のがんゲノムデータベースを構築してきました。また、2020年には厚生労働省より「がんゲノム医療中核拠点病院※5」としての指定を受け、静岡県内のがんゲノム医療連携病院7施設※6とともに「がんゲノムプロファイリング検査(以下、CGP検査※7)」を保険診療として実施しています。そして2021年から参画した 「がん全ゲノム解析等における患者還元に関する研究」※3では、手術を受けた患者を対象に全ゲノム解析を行い、その結果を専門家会議(エキスパートパネル)で討議し候補となる承認薬の提示や遺伝子変化の全体像を患者や担当医に情報提供することで診療への活用を進めています。現在までに実施された500例を超える症例の検討過程で、全ゲノム解析を臨床導入するための評価方法、業務手順のモデルや報告書様式の検討に加え、臨床的に意義のある遺伝子変化やバイオマーカーの探索を行い、新たな治療法開発への可能性を模索しています。
全ゲノム解析を臨床検査として実施するにあたっては、既に保険診療で実施されているCGP検査と同様に、研究報告やデータベースの情報に基づき腫瘍の遺伝子変化の情報を精査します。しかしながら、数十から数百の限られた遺伝子を対象にするCGP検査に比べ、全ゲノム解析ではそこから得られるゲノム情報の種類と情報量(検出される遺伝子変化の数)が格段に多く、その膨大な情報の中には、現時点では治療と関連付けることは出来ないものの、数年後治療を受ける際には新たな知見の集積や薬剤開発が進み、治療に活かせる情報が含まれている可能性があります。そのため、提供する必要性の高い重要な遺伝子変化情報を的確にかつ効率的に抽出するとともに、数年後を見据えた出来る限り多くの情報をわかりやすく説明できる“全ゲノム解析に求められる情報量と質が確保された検査結果報告書”の作成が必要です。ゲノム医療の実施には、検査結果の評価や検査結果報告書を作成する上で高度で専門的なスキルが求められるのに加えて、その工程数が多く、かつ複雑なため、限られた遺伝子を対象としたCGP検査を実施している現段階において、既に関与する従事者の負担が大きな課題になっています。そのため、さらに全ゲノム解析を臨床検査として実施するためには、ゲノム医療の業務改革が必要不可欠です。
そこで、当施設では全ゲノム解析に求められる情報量と質が確保された検査結果報告書の作成、そして蓄積したゲノムビッグデータを用いた治療法開発への活用を可能にするとともに、「がんゲノム医療」の課題である従事者の業務負担の軽減を実現する「がんゲノム医療統合システム (がんゲノム検査業務支援・報告書作成システム)」を、富士通Japan株式会社(本社: 東京都港区、代表取締役社長 長堀 泉)とともに開発してきました。
システムの概要
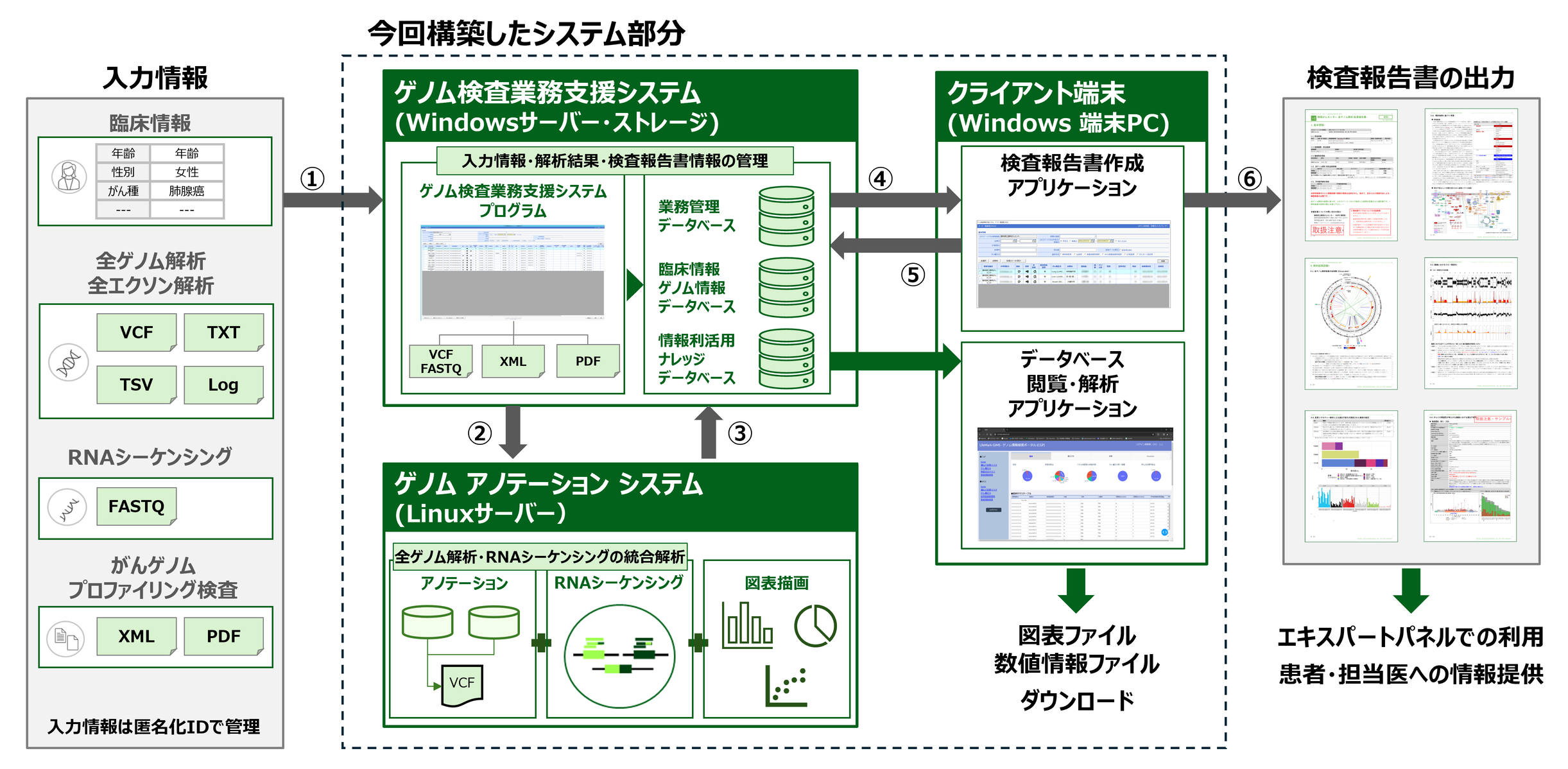
本システムは、システムの中核となる「ゲノム検査業務支援システム」、検査結果の評価を行う「ゲノムアノテーションシステム」、そして操作用の「クライアント端末」から構成されており、複数のクライアントPCから同時作業が可能です(図1)。また、全ゲノム解析およびRNA-seqだけでなく、CGP検査を含む広くゲノム検査への対応が柔軟にできるように設計しており、その上で解析結果をエキスパートパネルでの討議や、患者や担当医に報告するための報告書まで作成できる、ゲノム医療において広く活用ができる国内初の「がんゲノム医療統合システム」となります。
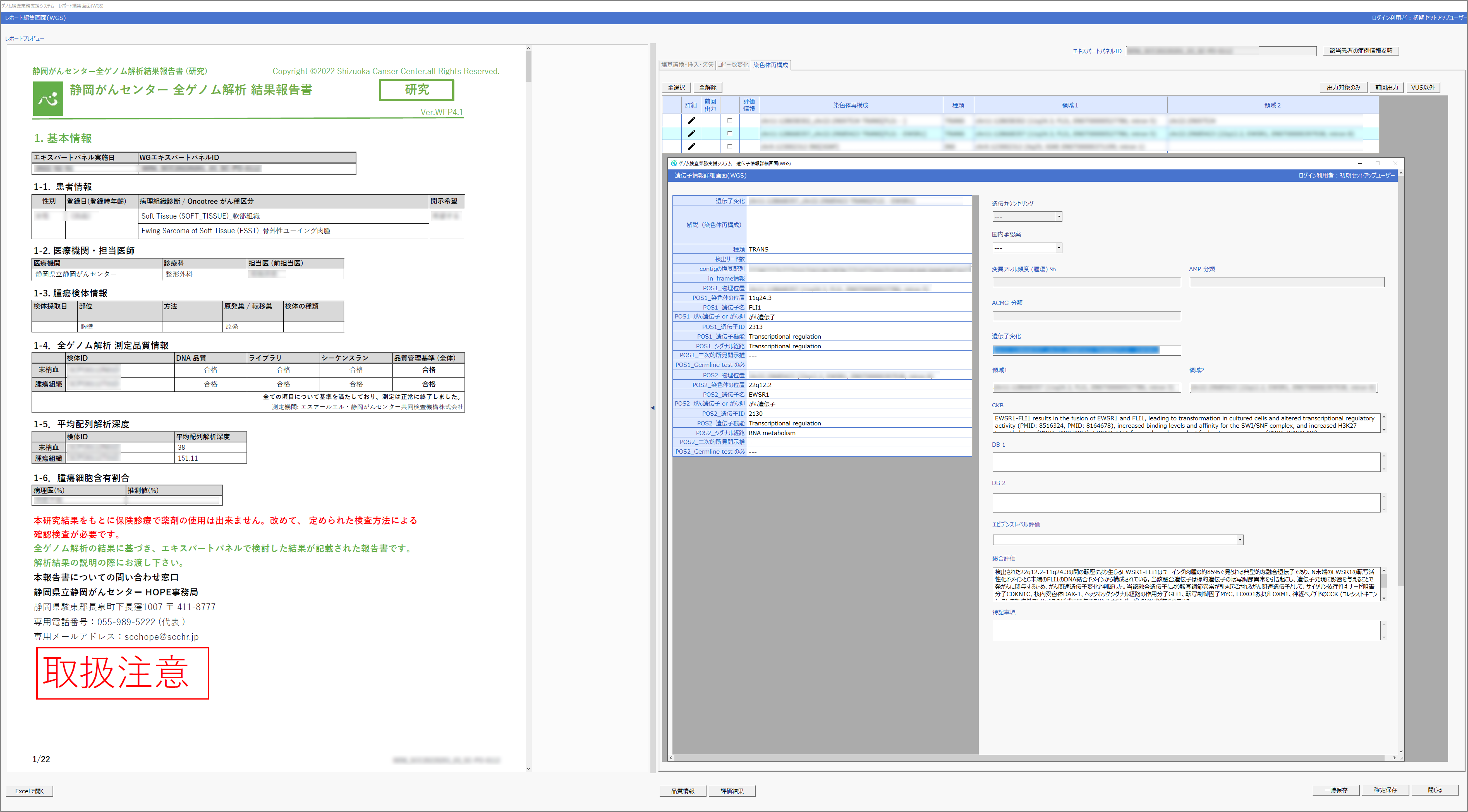
特長1.検査結果報告書作成の半自動化とゲノムデータの活用を見据えたデータ蓄積
全ゲノム解析をはじめとするゲノム検査の結果および臨床情報のファイルをシステムに取り込んだのち、検出された遺伝子変化に対して公共データベースの情報や研究情報を自動的に付加するとともに、今までの検査結果や当施設の「プロジェクトHOPE」の結果を基に、がんとの関連性を半自動で評価します。報告書の草稿の作成は、本システムに必要なファイルの入力の後、8症例を1セットとした並行処理が行われ、1セットあたり約3時間で終了します※7。これは現在の手作業では数日を要する作業になるため、本システムの導入は大幅な労力の軽減と作業時間の短縮につながります。また、その草稿に対し、腫瘍細胞のゲノムの特徴や、検査結果から導き出した発症・病態の進展に遺伝子変化が与える影響についての考察など記載し、より詳細な評価情報を含む報告書を作成することが可能です(図2)。検査結果、入力情報、評価結果、そして報告書に記載した詳細情報など全ての情報は、システム内のデータベースに保存され、次回以降の症例の評価に活用出来ます。そのため、症例数の増加に伴う情報の蓄積がシステムを成長させ、本システムの運用効果を高めるとともに、ゲノム検査を受けた患者やその担当医へ提供する報告書の情報量と質のさらなる向上を実現することにつながります。また、格納された情報は、新たな検査結果の評価に活用するだけでなく、データベース閲覧・解析アプリケーションの集計機能を用いて可視化することで、システム内に蓄積されたゲノムビッグデータの全体像を把握し、そして活用することが可能であり、新たな治療開発研究の発案につながることが期待されます。
特長2.全ゲノム解析とRNA-seqの統合解析による患者へ提供する遺伝子変化情報の精度の向上
本システムは全ゲノム解析にRNA-seqの結果を統合して評価する機能を有しています。RNA-seqは、ゲノム上の遺伝子配列に基づき作られる遺伝子産物であるRNAの配列情報を明らかにする解析手法です。RNA-seqを活用することで、変化が起きた腫瘍のゲノム配列をもとに実際に作られている腫瘍特異的な遺伝子産物をRNAの情報として明らかに出来、腫瘍の発生や進展に影響を与えている遺伝子変化にせまることができます。例えば、腫瘍において起きる染色体の変化(転座、欠失、逆位、挿入など)が原因となって作られる発がんに関与する融合遺伝子の検出精度および効率を高めることや、染色体の変化が遺伝子産物の作られる量(遺伝子発現量)に与える影響について評価が可能となります。そのため、全ゲノム解析とRNA-seqの併用は、腫瘍において起きている遺伝子変化の中から腫瘍の発生や進展に関与する重要な情報を抽出する上で効果的であり、患者へ提供する遺伝子変化の情報の精度を高めるとともに、検査結果の評価業務の負担軽減にもつながります。
※1 全ゲノム解析(Whole Genome Sequencing)
ゲノムは「全染色体の塩基配列(DNA)に書かれている遺伝情報の全て」と定義されています。そして、そのDNAの配列には、細胞が機能し、生命活動を維持するために働く「タンパク質」を作るための設計図となる情報が載っている領域があり、それが「遺伝子」です。ヒトには約20,000の遺伝子があります。全ゲノム解析では、その遺伝子部分だけでなく、非遺伝子部分も含めDNA配列情報を明らかにします。これまでは、遺伝子の領域を中心に解析する全エクソン解析が中心でしたが、DNAの配列を解析する分析・情報機器および解析技術の進化、そしてその技術の進化による解析コストの低下により全ゲノム解析を臨床検査として実施することが現実的になってきました。
※2 RNA-Seq:RNAシーケンシング(RNA sequencing)
遺伝子の情報に基づいて、タンパク質が合成される過程には、大きく2段階ありDNAからメッセンジャーRNA (mRNA)が合成される「転写」、そしてmRNAの配列に基づきタンパクが合成される「翻訳」の過程があります。ヒトをはじめとする真核生物の遺伝子の領域内には、タンパク質を合成するための情報が載っている「エクソン」と呼ばれる領域と、その間に挟まれる「イントロン」と呼ばれる領域があります。そのため、DNAを鋳型にmRNAを合成する「転写」の過程にはイントロン領域を除去する「RNAスプライシング」という過程があります。このRNAスプライシング後のmRNA(転写産物)の配列を解析するのがRNA-seqです。RNA-seqでは配列情報に基づき定量化を行い、遺伝子から作られるmRNAの量(遺伝子発現量)を調べることができます。また、染色体の変化(転座、欠失、逆位、挿入など)により2種類の遺伝子が結合し融合遺伝子が形成されますが、その中から条件が整い発現に至っている融合遺伝子を融合転写産物として検出できます。
※3 日本医療研究開発機構(AMED)革新的がん医療実用化研究事業名
・2021年10月~
「がん全ゲノム解析等における患者還元に関する研究」
8000症例マルチオミクス解析の経験にもとづく、全ゲノム解析の患者還元に関する研究
(https://www.scchr.jp/press/20211007-2.html)
・2023年4月~
「がん全ゲノム解析等の患者還元の拡大および創薬や治療法等の創出をめざした研究」
10,000症例マルチオミクス解析の経験にもとづく、全ゲノム解析の患者還元に関する研究
※4 プロジェクトHOPE (High-tech Omics-based Patient Evaluation)
https://www.scchr.jp/project-hope/index.html
※5 がんゲノム医療中核拠点病院
https://for-patients.c-cat.ncc.go.jp/common/pdf/Hospitals20240301.pdf
※6 静岡県内のがんゲノム医療連携病院7施設
浜松医科大学医学部附属病院、浜松医療センター、総合病院聖隷三方原病院、静岡県立総合病院、総合病院聖隷浜松病院、磐田市立総合病院、藤枝市立総合病院
※7 CGP検査:がんゲノムプロファイリング検査
https://ganjoho.jp/public/dia_tre/treatment/genomic_medicine/genmed02.html
※8 イルミナ社 DRAGEN Bio-IT Platformを全ゲノム解析の1次解析で利用し、その出力ファイルを利用した場合
図1 「がんゲノム医療統合システム」概要図
図2 システム操作画面のイメージ
●開発に携わった職員より
芹澤昌邦(静岡がんセンター研究所 新規薬剤開発・評価研究部 ゲノム創薬研究室長)
当施設では、本システムの開発を「がんゲノム医療のデジタルトランスフォーメーション (DX)」と位置づけています。デジタル技術を活用してがんゲノム医療の業務改革を行うことで、患者および担当医へ数年後の治療における活用を見据えた出来る限り多くの情報をわかりやすく提供できるとともに、関与する従事者の業務負担の軽減に寄与することが出来ると考えています。また、今後の目標として、本システムを活用して評価情報や検査結果報告書への記載コメントも含めた情報を体系的に蓄積し、それを活用した生成系AIを用いた検査結果報告書作成の自動化を進めることで、より簡便に利用できる次世代システムに発展させることを目指しています。静岡がんセンターは、今後も、がんゲノム医療中核拠点病院として、我が国のがんゲノム医療の発展に貢献してまいります。
●プレスリリース(PDF)
国内初 全ゲノム解析・RNAシーケンシングを併用するゲノム検査に対応した「がんゲノム医療統合システム」を構築~がんゲノム検査結果報告書の作成、従事者の業務負担の軽減に寄与~がんゲノム医療のDXに貢献(PDF:1240KB)
【関連サイト】
・プレスリリース(富士通Japan株式会社)![]()
・プレスリリース(2021年10月7日):AMED (日本医療研究開発機構)の“全ゲノム解析による患者還元体制構築研究”に参画 プロジェクトHOPEの知見が我が国の「全ゲノム解析等実行計画」に貢献
本リリースに関するお問い合わせ
本リリースに関するお問い合わせは下記までお願いいたします。
静岡県立静岡がんセンター マネジメントセンター 医療広報担当
電話:055(989)5222(代表)